- Home
- /
- Percorso Nascita
- /
- Il rischio in gravidanza
- /
- Infezioni
- /
- I farmaci antivirali sono...
I farmaci antivirali sono efficaci per il trattamento dell'influenza?
I farmaci antivirali inibitori delle neuroaminidasi (NAI) sono utilizzati per bloccare la replicazione virale e ridurre l’entità della malattia influenzale. L’utilizzo di questi farmaci in fase precoce di malattia durante la pandemia H1/N1 del 2009 si è associato a riduzione di mortalità, malattia grave e polmoniti. Non esistono studi indipendenti di buona qualità che ne confermino l’efficacia in gravidanza in corso di influenza stagionale.
Prima dell’influenza pandemica A/H1N1 del 2009 alcuni studi randomizzati controllati (RCT) [1-4] hanno rilevato la capacità dei farmaci antivirali inibitori della neuroaminidasi (NAI, neuraminidase inhibitors), come oseltamivir, zanamivir e peramivir, di ridurre la sintomatologia antinfluenzale attraverso l’inibizione della replicazione del virus. Le prove di efficacia [5] precedenti al 2009 suggeriscono un effetto protettivo anche nei confronti dell’evoluzione grave della malattia e di morte, ma sono basate su studi di qualità bassa o molto bassa.
L’efficacia della terapia antivirale in corso di pandemia A/H1N1 del 2009 è stata valutata in una revisione sistematica (RS) [6] che include 90 studi osservazionali (caso-controllo e studi di coorte) condotti tra marzo 2009 e agosto 2010 in 4 continenti (Nord e Sud America, Asia, Europa e Oceania) su pazienti ricoverati per influenza diagnosticata clinicamente o con indagini di laboratorio, attraverso la valutazione di 3 esiti: mortalità (44 studi, n=23.723), malattia grave come esito composito di ricoveri in terapia intensiva e decessi (52 studi, n=31.428) e polmonite (13 studi, n=3.271). I gruppi di intervento a confronto differivano per tempistica di inizio della terapia rispetto all’insorgenza dei sintomi: inizio precoce entro 48 ore dall’esordio dei sintomi, inizio dopo 48 ore, inizio dopo ricovero ospedaliero oppure assenza di terapia.
La tabella 1 riporta alcuni dei risultati più importanti:
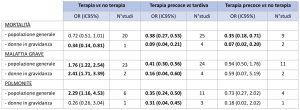
Tabella 1. Efficacia della terapia antivirale in corso di pandemia A/H1N1 [6]. In grassetto i risultati statisticamente significativi. OR: odd ratio, IC95%: intervallo di confidenza al 95%.
I risultati evidenziano l’efficacia dei NAI iniziati entro 48 ore dall’insorgenza della sintomatologia dell’influenza A/H1N1 nel ridurre gli esiti avversi (mortalità, malattia grave e polmonite) sia nella popolazione generale che nel sottogruppo delle donne in gravidanza. Tra i limiti della RS, chi ha firmato lo studio dichiara l’eterogeneità degli studi, la mancanza di aggiustamento per altri fattori di rischio (fra cui l’utilizzo di altri farmaci) e per la diversa propensione all’utilizzo di antivirali nei diversi setting. Inoltre, gli studi relativi alle donne in gravidanza presentano scarsa numerosità del campione [7-14]. L’incremento del rischio di malattia grave e polmonite nella popolazione sottoposta a terapia, rispetto a chi non assumeva terapia (colonna 1), potrebbe essere dovuto, secondo gli autori, alla propensione a iniziare la terapia anche tardivamente nei casi clinicamente più gravi e di rinunciarvi, invece, nei casi in via di guarigione spontanea.
Un importante studio multicentrico finanziato da una delle aziende produttrici dei farmaci antivirali, PRIDE Study (Post-pandemic Review of anti-Influenza Drug Effectiveness), ha cercato di valutare l’efficacia dei NAI su esiti di salute pubblica in corso di pandemia A/H1N1 del 2009, basandosi sulla metanalisi dei dati dei singoli pazienti ottenuti da 80 centri.
La prima metanalisi [15] pubblicata dal PRIDE Study valuta l’efficacia dei NAI nella riduzione della mortalità in 29.324 pazienti, ricoverati tra gennaio 2009 e marzo 2011, in 38 paesi delle 6 regioni dell’Organizzazione Mondiale della Sanità (Africa, Pacifico occidentale, Mediterraneo orientale, Sud-est Asiatico, Europa, Americhe). I risultati mostrano una significativa riduzione del rischio di mortalità nel gruppo trattato con NAI precocemente, la riduzione si mantiene statisticamente significativa dopo aggiustamento per propensione all’utilizzo dei NAI, uso di terapia antibiotica e corticosteroidea sia nella popolazione generale che nelle donne in gravidanza. I risultati di maggiore interesse sono riportati in tabella 2.
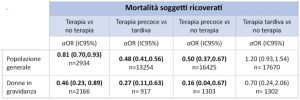
Tabella 2. Effetti della terapia antivirale sulla mortalità delle persone ricoverate per influenza H1N1 [15]. In grassetto i risultati statisticamente significativi. OR: odd ratio, IC95%: intervallo di confidenza al 95%.
Una seconda metanalisi [16] dal PRIDE Study valuta l’efficacia dei NAI nella riduzione dei ricoveri per malattia influenzale in 3.376 pazienti (9 paesi di 3 continenti) con influenza A/H1N1confermata da esami di laboratorio (91.4%) o clinicamente diagnosticata. I risultati mostrano una riduzione del rischio di ricovero nei pazienti in terapia, con odds ratio (OR) aggiustato per utilizzo di antibiotici e propensione all’uso di NAI pari a 0.24 (intervallo di confidenza al 95% – IC95%: 0.20, 0.30). Il dato relativo al momento di inizio della terapia rispetto ai sintomi è noto solamente in 473 pazienti (14.0% del campione totale), in cui si conferma maggiore efficacia dell’inizio precoce (entro 48 ore) rispetto all’inizio tardivo (aOR: 0.44; IC95%: 0.23, 0.86). Ma i risultati di questa metanalisi devono essere interpretati con cautela sia perché la popolazione inclusa risulta ad alto rischio (87.2% dei pazienti presentavano almeno una comorbosità sottostante come asma, malattie polmonari croniche ostruttive o altre patologie) sia perché il ricovero è riportato in una percentuale di casi molto elevata (50.5%) sollevando dubbi sulla possibilità di osservare gli stessi risultati in una popolazione diversa (validità esterna o generalizzabilità dello studio). Gli autori stessi sottolineano che i dati sono limitati al periodo pandemico del 2009 e i risultati non possono essere generalizzati nella popolazione non a rischio e in corso delle influenze stagionali [16].
I risultati principali di queste metanalisi sono stati messi in discussione da una successiva RS indipendente [17]. Le persone che conducono la ricerca non identificano RCT pubblicati, mentre individuano 107 studi dai registri delle agenzie di sorveglianza nazionali e internazionali (US Food and Drug Administration, European Medicines Agency e Japanese Regulator) e 46 studi finanziati dalle case farmaceutiche produttrici . Tutti gli studi sono giudicati ad alto rischio di bias (attrition bias e selective reporting bias): in 10 studi su oseltamivir non è descritto il processo di randomizzazione e in 11 studi le capsule di placebo mostravano aspetto differente da quelle del farmaco, mentre 25 studi su zanamivir non descrivono il processo di randomizzazione e solamente uno descrive le apparenze del farmaco e del placebo. I risultati più significativi sono riportati in tabella 3.
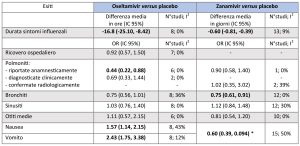
Tabella 3. Efficacia della terapia antivirale [17]. In grassetto i risultati statisticamente significativi. OR: odd ratio, IC95%: intervallo di confidenza al 95%, I2: eterogeneità
Una successiva RS di dati individuali provenienti da 9 RCT [18], sponsorizzata dall’azienda produttrice di oseltamivir, ha valutato l’efficacia del farmaco al dosaggio standard di 75 mg x 2/die per 5 giorni: gli studi inclusi vengono definiti dagli autori “soddisfacenti i criteri di buona pratica clinica”, mentre gli stessi erano stati definiti ad alto rischio di selection, attrition, reporting o performance bias nella precedente RS indipendente [17]. Gli esiti del trattamento quali miglioramento della sintomatologia, riduzione delle complicanze della malattia e ricovero ospedaliero sono analizzati nel campione generale, “intention-to-treat-population” (n=4.328) e nel sottogruppo delle persone con influenza accertata da indagini di laboratorio (esame colturale dei secreti orofaringei o aumento dei titoli anticorpali alle indagini sierologiche), “intention-to-treat infected population” (n=2.893). I risultati della metanalisi sono:
- riduzione della durata mediana dei sintomi quali congestione nasale, mal di gola, tosse, dolori, affaticamento, mal di testa, brividi o sudori: -17.8 ore (IC95%: -27.1, -9.3), pari a riduzione di 15% del tempo totale dei sintomi nel campione totale e -25.2 ore (IC95%: -36.2, -16.0), pari a 21% della durata dei sintomi, nel sottogruppo con infezione accertata;
- riduzione delle complicanze del basso tratto respiratorio quali bronchiti e polmoniti diagnosticate solo su base clinica e trattate con terapia antibiotica dopo 48 ore: rispettivamente RR: 0.62 (IC95%: 0.49, 0.79) nel primo gruppo e RR: 0.56 (IC95%: 0.42, 0.75) nel secondo gruppo;
- riduzione dei ricoveri ospedalieri per qualsiasi causa, statisticamente significativa nel solo sottogruppo dei pazienti con infezione confermata: RR: 0.37 (IC95%: 0.17, 0.81);
- aumento del rischio di nausea e vomito in entrambi i gruppi: rispettivamente RR per nausea: 1.60 (IC95%: 1.29, 1.99) e RR per vomito: 2.43 (IC 95%: 1.83, 3.23) nel campione totale e RR per nausea: 1.60 (IC95%: 1.24, 2.07) e RR per vomito: 3.00 (IC95%: 2.11, 4.26) nel sottogruppo di pazienti con infezione accertata.
La diversa valutazione della qualità degli studi inclusi nella metanalisi finanziata dalle ditte produttrici e in quella indipendente, l’incerta definizione di alcuni esiti primari (es. diagnosi di polmoniti o criteri di utilizzo di terapia antibiotica per il trattamento delle complicanze), il limitato valore clinico nella riduzione dei sintomi generali e l’aumento significativo degli effetti avversi sollevano molte perplessità rispetto alle conclusioni di questa metanalisi [17-26].
Nel 2022, Organizzazione Mondiale della Sanità (WHO, World Health Organization) ha valutato le prove di efficacia della terapia antivirale nelle persone con malattia grave o a rischio di svilupparla in caso di infezione sospettata o laboratoristicamente confermata [27]. I risultati (non specifici per la popolazione in gravidanza) riportano la riduzione di alcuni esiti avversi, quali:
- mortalità: OR: 0.38 (IC95%:0.19,0.75; 8 studi osservazionali; n=4.725)
- ricoveri: OR: 0.65 (IC95%: 0.48, 0.87; 2 studi osservazionali; n=14.445)
- complicanze cardiovascolari: OR: 0.41 (IC95%: 0.34, 0.49; 1 studio osservazionale; n=37.482)
- eventi cardiaci: OR 0.49 (IC95%: 0.25,0.97; 6 RCT; n=3.943)
- complicanze neuropsichiatriche: OR 0.86 (IC95%: 0.79, 0.93; 3 studi osservazionali; n=359.228).
Tutti i risultati sono tutti giudicati dal gruppo multidisciplinare di esperti (Guideline Development Group-GDG) a rischio di bias molto alto e caratterizzati da livelli di evidenza “basso” o “molto basso”.
Una successiva rivalutazione delle prove commissionata da WHO ha sintetizzato l’efficacia dei NAI in due RS: una ha incluso solo i casi di persone con influenza grave (ricoverate in ospedale), la seconda solo i casi di influenza non grave.
La prima RS [28] ha identificato 8 RCT (n=1.424), a partire da 459 articoli individuali, di cui 6 inclusi nella metanalisi. I risultati di maggior interesse rispetto agli esiti indagati sono:
- nessuna differenza in termini di mortalità (4 RCT, n=813): differenza di rischio (risk difference, RD) tra -18 e +4 per 1000, in particolare RR 0.53 (IC 95%: 0.07, 4.24; 1 RCT; n=74) per oseltamivir e 0.58 (IC 95%: 0.067, 5.29; evidenze indirette) per zanamivir. Livello di evidenza molto basso.
- nessuna differenza in termini di ricoveri in terapia intensiva (2 RCT, n=235): RD tra -29 e +43 per 1000. Livello di evidenza molto basso.
- riduzione della durata del ricovero (2 RCT, n=104); differenza media (mean difference, MD) 1.63 (IC 95%: -2.81, -0.45) per utilizzo di oseltamivir. Livello di evidenza basso.
- nessuna riduzione significativa della durata dei sintomi (3 RCT, n=238): MD 0.34 giorni (IC 95%: -0.86, 1.54) per utilizzo di oseltamivir. Livello di evidenza basso.
- dati non sufficienti per valutare la frequenza di effetti avversi della terapia (2 RCT, n=752). Livello di evidenza molto basso.
Seppur con alcuni limiti metodologici (basso numero di RCT inclusi nella metanalisi, impossibilità di eseguire metanalisi su specifici sottogruppi, rischio di bias da inadeguata allocazione, mancanza di cecità e dati incompleti sugli esiti in alcuni studi), la RS suggerisce che i NAI potrebbero ridurre la durata dei ricoveri ospedalieri in caso di malattia grave, senza effetti positivi certi sulla mortalità o altri esiti avversi dell’infezione influenzale.
La seconda RS sui casi di influenza non grave (sospetta o confermata laboratoristicamente), attualmente in corso di revisione pre-pubblicazione [29], ha identificato 73 studi (n= 34.332) e conclude che i NAI hanno probabilmente un effetto limitato o nullo o incerto sugli esiti dell’infezione.
Bibliografia
- Makela MJ, et al. Clinical efficacy and safety of the orally inhaled neuraminidase inhibitor zanamivir in the treatment of influenza: a randomized, double-blind, placebo-controlled European study. J Infect 2000;40:42-8. [Medline]
- Nicholson KG, et al. Efficacy and safety of oseltamivir in treatment of acute influenza: a randomised controlled trial. Neuraminidase Inhibitor Flu Treatment Investigator Group. Lancet 2000; 355:1845-50. [Medline]
- Treanor, et al. Efficacy and safety of the oral neuraminidase inhibitor oseltamivir in treating acute influenza: a randomized controlled trial. US Oral Neuraminidase Study Group.JAMA 2000; 283:1016-24. [Medline]
- Whitley RJ, et al. Oral oseltamivir treatment of influenza in children [erratum appears in Pediatr Infect Dis J 2001 20:421]. Pediatr Infect Dis J 2001; 20:127-33. [Medline]
- Hsu J, et al. Antivirals for treatment of influenza: a systematic review and meta-analysis of observational studies. Ann Intern Med 2012;156:512-24. [Medline]
- Muthuri SG et al.Impact of neuraminidase inhibitor treatment on outcomes of public health importance during the 2009-2010 influenza A(H1N1) pandemic: a systematic review and meta-analysis in hospitalized patients. Infect Dis 2013;207:553. [Medline]
- Nakai A, et al. Characteristics of pregnant Japanese women who required hospitalization for treatment of pandemic (H1N1) 2009–low mortality rate may be due to early antiviral use. J Infect 2011; 62:232-3. [Medline]
- Newsome K, et al. Maternal and infant outcomes among severely ill pregnant and postpartum women with 2009 pandemic influenza A (H1N1) – United States, April 2009-August 2010. Morbidity and Mortality Weekly Report 2011; 60:1193-6. [Medline]
- Siston AM, et al. Pandemic 2009 influenza A(H1N1) virus illness among pregnant women in the United States. Jama 2010; 303:1517-25. [Medline]
- Qiao C, et al. Effect of early antiviral treatment on perinatal prognosis of the pregnant women with severe H1N1 influenza virus infection. Maternal and Child Health Care of China 2011; 26:1566-9
- Figueiro-Filho EA, et al. Obstetric, clinical, and perinatal implications of H1N1 viral infection during pregnancy. International Journal of Gynecology and Obstetrics 2012; 116:214-8. [Medline]
- Creanga AA, et al. Severity of 2009 pandemic influenza A (H1N1) virus infection in pregnant women. Obstet Gynecol 2010; 115:717-26. [Medline]
- Yu H, et al. Risk factors for severe illness with 2009 pandemic influenza A (H1N1) virus infection in China. Clin Infect Dis 2011; 52:457-65. [Medline]
- Dubar G, et al. French experience of 2009 A/H1N1v influenza in pregnant women. PLoS One 2010;5. pii: e13112.
- Muthuri SG, et al. Effectiveness of neuraminidase inhibitors in reducing mortality in patients admitted to hospital with influenza A H1N1pdm09 virus infection: a meta-analysis of individual participant data. Lancet Respir Med 2014;2:395-404. [Medline]
- Venkatesan S, et al.Impact of Outpatient Neuraminidase Inhibitor Treatment in Patients Infected With Influenza A(H1N1)pdm09 at High Risk of Hospitalization: An Individual Participant Data Metaanalysis.Clin Infect Dis 2017;64:1328-34. [Medline]
- Jefferson T, et al. Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children. Cochrane Database Syst Rev 2014; CD008965. [Medline]
- Dobson J, et al. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. Lancet 2015;385:1729-37. [Medline]
- Kelly H, et al.Influenza: the rational use of oseltamivir. Lancet 2015;385:1700-02. [Medline]
- Jones M, al. Oseltamivir for influenza.Lancet 2015;386:1133-4. [Medline]
- Doshi P, et al. Oseltamivir for influenza. Lancet. 2015;386:1134-5. [Medline]
- Radecki RP. Oseltamivir for influenza. Lancet 20159;386:1134 [Medline]
- Kubo K, et al. Oseltamivir for influenza. Lancet 2015;386:1135. [Medline]
- Monto AS, et al. Oseltamivir for influenza – Authors’ reply. Lancet 2015;386:1135-6. [Medline]
- Doshi P, et al. Oseltamivir for influenza. Lancet 2016;387:124. [Medline]
- Monto AS, et al. Oseltamivir for influenza – Authors’ reply. Lancet 2016;387:125. [Medline]
- World Health Organization. Guidelines for the clinical management of severe illness from influenza virus infections. Geneva, 2022. [Testo integrale] Ultimo accesso 13.11.2025
- Gao Y, Zhao Y, Liu M, Luo S, Chen Y, Chen X et al. Antivirals for treatment of non-severe influenza: a systematic review and network meta-analysis of randomized controlled trials. medRxiv 2024:2024.05.28.24307936
- Gao Y et al. Antivirals for treatment of non-severe influenza: a systematic review and network meta-analysis of randomized controlled trials. medRxiv 2024. doi:https://www.doi.org/10.1101/2024.05.28.24307936
